Ligação Iônica(eletrovalente)
Introdução:
Gases Nobres (8A): são encontrados isoladamente porque são estáveis por natureza. O gás hélio (He) tem dois elétrons na camada K. O neônio (Ne), argônio (Ar), criptônio (Kr), xenônio (Xe) e radônio (Rn) apresentam oito elétrons na camada de valência (que é a última camada).
Teoria do Octeto: os átomos ligam-se, isto é, eles tendem a perder, ganhar ou compartilhar elétrons, procurando adquirir configuração eletrônica de gás nobre mais próximo deles, na tabela periódica.
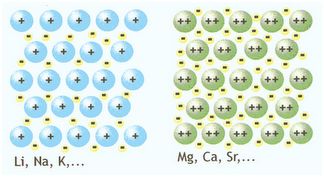
Metais: possuem menos de quatro elétrons na camada de valência, apresentam alta eletropositividade, adquirem o octeto perdendo elétron(s) e estabilizam-se formando cátions.
Ametais ou Não-Metais: possuem mais de quatro elétrons na camada de valência, apresentam alta eletronegatividade, adquirem o octeto ganhando elétron(s) e estabilizam-se formando ânions.
Ligação Química Iônica ou Eletrovalente
A ligação iônica consiste na transferência de elétron(s) de um metal (íon catiônico) para um ametal (íon aniônico). Essa transferência de elétron(s) é originária de uma forte atração eletrostática entre esses íons. Os compostos que apresentam essa ligação são chamados compostos iônicos.

Utilizando o método de Lewis, no qual é representado o último nível eletrônico do átomo ou camada de valência por pontos.

Escrevendo a fórmula iônica, temos:
[Na]+ [Cl]-
Portanto sua fórmula iônica é NaCl.
Características das Substâncias Iônicas:
As fortes atrações eletrostáticas entre cátions e ânions, em uma substância iônica, têm suas conseqüências;
- Toda substância iônica é sólida e forma um retículo cristalino, nas condições ambientes.
- Os pontos de Fusão (PF) e de ebulição (PE) são bem altos.
- As substâncias iônicas conduzem corrente elétrica quando fundidas ou quando dissolvidas em água.
Metal + Ametal → Ligação Iônica → Substância Iônica → Sólido
Ligação Covalente
As ligações covalentes podem ocorrer na forma Molecular ou Dativa e Coordenada.
Ligação covalente molecular
Nessa ligação, os átomos são unidos devido ao compartilhar de seus elétrons, surgem então os pares eletrônicos indicados pelo círculo:

Ligação covalente molecular de dois átomos de Cloro (Cl).
Cada par eletrônico formado pertence simultaneamente aos dois átomos. As moléculas são estruturas eletricamente neutras porque não ocorre nem ganho nem perda de elétrons, apenas o compartilhamento.
A água é um composto molecular constituído por dois átomos de hidrogênio (H2) e um de oxigênio (O).
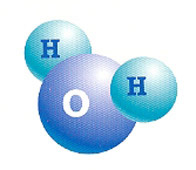
Ligação covalente dativa e coordenada
Essa ligação obedece a Teoria do Octeto: Os átomos se unem tentando adquirir oito elétrons na camada de valência, ou seja, a configuração eletrônica dos gases nobres.
Sendo assim, um átomo que já atingiu a estabilidade eletrônica se une a outro que necessita de elétrons para completar a camada de valência. Um exemplo dessa ligação é quando um átomo de enxofre se liga a dois de oxigênio para formar o dióxido de enxofre (SO2).
O átomo de enxofre (S) adquire seu octeto com formação de uma dupla ligação com o oxigênio localizado à esquerda (ligação coordenada), mas ao mesmo tempo o oxigênio posicionado à direita necessita de elétrons para completar seu octeto. Surge então a ligação covalente dativa representada por um pequeno vetor (seta). A seta indica que o “S” está doando um par de elétrons para o “O”.
Vejamos o compartilhamento de elétrons na formação do composto trióxido de enxofre (SO3).
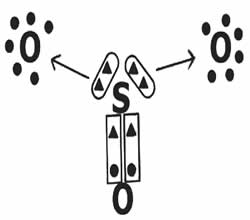
Note que o elemento central (enxofre) estabelece uma dupla ligação (coordenada) com um dos oxigênios, atingindo a estabilidade eletrônica (oito elétrons na camada de valência). Por outro lado, doa dois pares de elétrons para os oxigênios (ligação dativa indicada pela seta →) na tentativa de completar o octeto.
Ligação Metálica
A grande maioria dos metais já identificados possui propriedades físico-químicas bem semelhantes: facilidade em perder elétrons (frente ao seu ganho, em geral), elevados pontos de fusão e ebulição, boa condutividade elétrica e térmica, brilho característico.
Boa parte dessas propriedades são frutos da interação entre os átomos
na rede cristalina que compõe o metal: observa-se que há um mesmo tipo
de ligação entre átomos, que se repete ao longo da rede. Assim, é
definida a ligação metálica.
O metal com maior ponto de fusão da tabela periódica é o tungstênio (PE = 3422°C), e isso é devido à interação dos átomos que o constitui: as forças de atração são tão intensas, que é necessária grande quantidade de energia para superá-las. Do mesmo modo, o ósmio é o elemento mais denso (d = 22,6), justamente pela forma de empacotamento que os cristais apresentam.
 Os
cátions de um metal encontram-se unidos por um “mar” de elétrons
vizinhos: eles recobrem toda a superfície do metal, por isso corrente
elétrica pode ser transmitida sem muita resistência.
Os
cátions de um metal encontram-se unidos por um “mar” de elétrons
vizinhos: eles recobrem toda a superfície do metal, por isso corrente
elétrica pode ser transmitida sem muita resistência.
O sódio, por exemplo, apresenta íons Na+ lado a lado (com distância média praticamente constante) que permanecem submersos a uma camada de elétrons, quase que totalmente livres. Porque ainda que algumas literaturas considerem os elétrons de uma estrutura metálica livres, ainda será desprendida energia para ionizá-la; além disso, não pode ser deixado de lado o fato que a estrutura apresenta carga elétrica total nula e que, portanto, os elétrons não são totalmente externos aos átomos do retículo (mesmo que esse “mar” seja constituído por elétrons de valência – em constante movimento).
Assim como os outros sólidos, os metais são intimamente organizados por estruturas unitárias (células unitárias) que se repetem ao longo da cadeia.
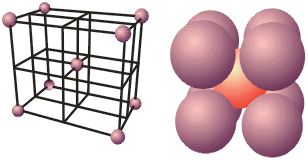 Como
já citado anteriormente, os elétrons de uma barra de cobre, por
exemplo, possuem certa mobilidade. Assim, se for aplicado uma diferença
de potencial em um dos lados dessa barra, certamente haverá condução de corrente elétrica.
Assim como, se uma das pontas for aquecida, também haverá condução de
calor (a outra ponta também aumentará de temperatura, gradativamente).
Como
já citado anteriormente, os elétrons de uma barra de cobre, por
exemplo, possuem certa mobilidade. Assim, se for aplicado uma diferença
de potencial em um dos lados dessa barra, certamente haverá condução de corrente elétrica.
Assim como, se uma das pontas for aquecida, também haverá condução de
calor (a outra ponta também aumentará de temperatura, gradativamente).
Esses efeitos dão-se pela presença de tais elétrons circundantes aos cátions: ao aplicar uma tensão U, os elétrons tenderão a movimentar-se ordenadamente da região de maior potencial para a de menor potencial elétrico. Logo, uma corrente elétrica será detectada. Isso significa que quanto mais elétrons constituírem circundarem os cátions metálicos, corrente de maior intensidade será observada.
A transmissão de calor dá-se de também obedecendo a um gradiente de energia: ao aquecermos uma parte da barra, aumentamos a energia dos cátions mais próximos a fonte (já que começam a oscilar com mais intensidade); e, como os elétrons encontram-se móveis ao redor dos cátions internos, adquirem maior velocidade por se chocarem com estes. A partir daí, com a colisão contra outros cátions mais lentos (mais afastados da fonte) há transferência de parte dessa energia adquirida pela nova velocidade alcançada e, portanto, é verificada macroscopicamente a efetiva transmissão de calor.
Fontes:
ATKINS, Peter. LORETTA, Jones. Princípios de química: questionando a vida moderna e o meio ambiente; tradução Ricardo Bicca de Alencastro. – 3ª Ed. – Porto Alegre: Bookman, 2006. 968 páginas.
O metal com maior ponto de fusão da tabela periódica é o tungstênio (PE = 3422°C), e isso é devido à interação dos átomos que o constitui: as forças de atração são tão intensas, que é necessária grande quantidade de energia para superá-las. Do mesmo modo, o ósmio é o elemento mais denso (d = 22,6), justamente pela forma de empacotamento que os cristais apresentam.
Aspectos da Ligação Metálica
 Os
cátions de um metal encontram-se unidos por um “mar” de elétrons
vizinhos: eles recobrem toda a superfície do metal, por isso corrente
elétrica pode ser transmitida sem muita resistência.
Os
cátions de um metal encontram-se unidos por um “mar” de elétrons
vizinhos: eles recobrem toda a superfície do metal, por isso corrente
elétrica pode ser transmitida sem muita resistência.O sódio, por exemplo, apresenta íons Na+ lado a lado (com distância média praticamente constante) que permanecem submersos a uma camada de elétrons, quase que totalmente livres. Porque ainda que algumas literaturas considerem os elétrons de uma estrutura metálica livres, ainda será desprendida energia para ionizá-la; além disso, não pode ser deixado de lado o fato que a estrutura apresenta carga elétrica total nula e que, portanto, os elétrons não são totalmente externos aos átomos do retículo (mesmo que esse “mar” seja constituído por elétrons de valência – em constante movimento).
Assim como os outros sólidos, os metais são intimamente organizados por estruturas unitárias (células unitárias) que se repetem ao longo da cadeia.
Transmissão de calor e eletricidade
 Como
já citado anteriormente, os elétrons de uma barra de cobre, por
exemplo, possuem certa mobilidade. Assim, se for aplicado uma diferença
de potencial em um dos lados dessa barra, certamente haverá condução de corrente elétrica.
Assim como, se uma das pontas for aquecida, também haverá condução de
calor (a outra ponta também aumentará de temperatura, gradativamente).
Como
já citado anteriormente, os elétrons de uma barra de cobre, por
exemplo, possuem certa mobilidade. Assim, se for aplicado uma diferença
de potencial em um dos lados dessa barra, certamente haverá condução de corrente elétrica.
Assim como, se uma das pontas for aquecida, também haverá condução de
calor (a outra ponta também aumentará de temperatura, gradativamente).Esses efeitos dão-se pela presença de tais elétrons circundantes aos cátions: ao aplicar uma tensão U, os elétrons tenderão a movimentar-se ordenadamente da região de maior potencial para a de menor potencial elétrico. Logo, uma corrente elétrica será detectada. Isso significa que quanto mais elétrons constituírem circundarem os cátions metálicos, corrente de maior intensidade será observada.
A transmissão de calor dá-se de também obedecendo a um gradiente de energia: ao aquecermos uma parte da barra, aumentamos a energia dos cátions mais próximos a fonte (já que começam a oscilar com mais intensidade); e, como os elétrons encontram-se móveis ao redor dos cátions internos, adquirem maior velocidade por se chocarem com estes. A partir daí, com a colisão contra outros cátions mais lentos (mais afastados da fonte) há transferência de parte dessa energia adquirida pela nova velocidade alcançada e, portanto, é verificada macroscopicamente a efetiva transmissão de calor.
Fontes:
ATKINS, Peter. LORETTA, Jones. Princípios de química: questionando a vida moderna e o meio ambiente; tradução Ricardo Bicca de Alencastro. – 3ª Ed. – Porto Alegre: Bookman, 2006. 968 páginas.
Nenhum comentário:
Postar um comentário